چند میلیارد سال پیش با انفجار بزرگ (BIG BANG) جهان بوجود آمد. جهانی که در ابتدا بسیار داغ بود (107K) اجازه به هم پیوستن ذرات اتم و ایجاد اتمها را نمیداد اما کمکم اتمهای اولیه که بیشتر شامل هیدروژن (89%) و هلیم (11%) بودند تشکیل شدند که با سرد شدن تدریجی دمای جهان و به هم پیوستن این اتمها به هم و ایجاد سحابیها و ستارهها، این اتمها در واکنشهای هم جوشی با آزاد کردن مقادیر بسیار زیادی انرژی به عناصر سنگینتر تبدیل شدند.
از چند قرن پیش که کمکم بشر عناصر را شناخت و تعداد عناصر شناسایی شده افزایش یافت نیاز به طبقهبندی آنها احساس گردید به طوری که در ابتدا عناصر را به دو دسته فلزات و نافلزات تقسیمبندی نمودند و بعد براساس ترکیباتی که تشکیل میدادند آنها را تقسیمبندی کردند.
تاریخچه
دانشمندان زیادی در دو قرن اخیر جدولهای طبقهبندی عنصرها را به شکلهای مختلف ارائه دادهاند اما در بین آنها کار دانشمندی روسی به نام دیمتری مندلیف اعتبار و شهرت زیادی پیدا کرده طوری که هماکنون نیز جدول تناوبی اصلاح شده مندلیف در کتب درسی مورد مطالعه قرار میگیرد.
بزرگترین پـیشرفت در زمینۀ دستهبندی عنصرها با كارهای مندلیف (۱۹۰۷ــ 1834میلادی) به دست آمد.
جدول تناوبی عناصر شیمیایی نمایشی از عناصر شیمیایی است که براساس ساختار الکترونی مرتب شده است، بطوریکه بسیاری از خواص شیمیایی بصورت منظم در طول جدول تغییر نماید. جدول اولیه بدون اطلاع از ساختار داخلی اتمها ساخته شد: اگر عناصر را بر حسب جرم اتمی آنها مرتب نمائیم، و آنگاه نمودار خواص معین دیگر آنها را بر حسب جرم اتمی رسم نمائیم، میتوان نوسان یا تناوب این خواص را بصورت تابعی از جرم اتمی مشاهده نمود. اولین کسی که توانست این نظم را مشاهده نماید، یک شیمیدان آلمانی به نام Johann Wolfgang D?einer بود. او متوجه تعدادی تثلیث از عناصر مشابه شد:
نمونه تثلیثها
و به دنبال او، شیمیدان انگلیسی جان الکساندر رینا نیولندز (John Alexander Reina Newlands) متوجه گردید که عناصر از نوع مشابه در فاصلههای هشتتایی یافت میشوند، که آنها را با نتهای هشتگانه موسیقی شبیه نمود، هرچند که قانون نتهای او مورد تمسخر معاصرین او قرار گرفت. سرانجام شیمیدان آلمانی لوتار میر (Lothar Meyer) و شیمیدان روسی دیمتری ایوانوویج مندلیف (Dmitry Ivanovich Mendeleev) تقریبا بطور همزمان اولین جدول تناوبی را، با مرتب نمودن عناصر بر حسب جرمشان، توسعه دادند (ولی مندلیف تعداد کمی از عناصر را خارج از ترتیب صریح جرمی، برای تطابق بهتر با خواص همسایگانشان رسم نمود – این کار بعدها با کشف ساختار الکترونی عناصر در اواخر قرن نوزدهم و اوایل قرن بیستم توجیه گردید). فهرست عناصر بر اساس نام، علامت اختصاری و عدد اتمی موجود میباشد.
تعداد لایه الکترون در یک اتم تعیینکننده ردیفی است که در آن قرار میگیرد. هر لایه به زیرلایههای متفاوتی تقسیم میشود، که هر اندازه عدد اتمی افزایش مییابد، این لایهها به ترتیب زیر:
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p
8s 5g 6f 7d 8p
…
براساس ساختار جدول پر میشوند. از آنجائیکه الکترونهای خارجیترین لایه، خواص شیمیایی را تعیین مینمایند، این لایهها در میان گروهای یکسان مشابهاند.عناصر همجوار با یکدیگر در یک گروه، علیرغم اختلاف مهم در جرم، دارای خواص فیزیکی مشابه میباشند. عناصر همجوار با یکدیگر در یک ردیف دارای جرمهای مشابه ولی خواص متفاوت میباشند.
برای مثال، عناصر بسیار نزدیک به نیتروژن (N) در ردیف دوم کربن (C) و اکسیژن (O) میباشند. علیرغم تشابه آنها در جرم (که بصورت ناچیزی در واحد جرم اتمی تفاوت دارند)، دارای خواص بینهایت متفاوتی هستند، همانطور که با بررسی فرمهای دیگر میتوان ملاحظه نمود، اکسیژن دو اتمی یک کاز است که سوختن را تشدید مینماید، نیتروژن دو اتمی یک گاز است که سوختن را تشدید نمیکند، و کربن یک جامد است که میتواند سوزانده شود ( بله، میتوان الماس را سوزاند!).
در مقایسه، عناصر بسیار نزدیک به کلر (Cl) در گروه یکی مانده به آخر (هالوژنها) در جدول، فلوئور (F) و برم (Br) میباشند. علیرغم تفاوت فاحش جرم آنها در گروه، فرمهای دیگر آنها دارای خواص بسیار مشابه میباشند؛ آنها بسیار خورنده (بدین معنی که تمایل خوبی برای ترکیب با فلزات، برای تشکیل نمک هالاید فلز)؛ کلر و فلوئور گاز هستند، درحالیکه برم یک مایع با تبخیر بسیار کم میباشد؛ کلر و برم بسیار رنگی هستند.
مندلیف و لوتار میر در مورد خواص عنصرها و ارتباط آنها بررسیهای دقیقتری انجام دادند و در سال ۱۸۶۹ به این نتیجه رسیدند که خواص عنصرها تابعی تناوبی از جرم آنهاست. به این معنا که اگر عنصرها را به ترتیب افزایش جرم اتمی مرتب شوند نوعی تناوب در آنها اشکار میگردد و پس از تعداد معینی از عنصرها، عنصرهایی با خواص مشابه خواص پیشین تکرار میشوند.
مندلیف در سال ۱۸۶۹ بر پایه قانون تناوب، جدولی از ۶۳ عنصر شناخته شده زمان خود منتشر کرد. در فاصله بین سالهای ۱۸۶۹ تا ۱۸۷۱ مندلیف هم مانند لوتار میر با بررسی خواص عنصرها و ترکیبهای آنها متوجه شد که تغییرهای خواص شیمیایی عنصرها مانند خواص فیزیکی آنها نسبت به جرم اتمی روند تناوبی دارد. از این رو جدول جدیدی در ۸ ستون و ۱۲سطر تنظیم کرد. او با توجه به نارساییهای جدول نیولندز و لوتار میر و حتی جدول قبلی خود جدولی تقریبا بدون نقص ارایه دادکه فراگیر وماندنی شد.
شاهکارهای مندلیف
اگر چه روشهای مختلفی برای ارائه جدول تناوبی وجود دارد و همه آنها ظاهر نامنظمی دارند، اما روابط بین عناصر و خواص آنها که مبنای جدول مندلیف را تشکیل میدهد، یک کشف قابل توجه بود. دانشمندان دریافتند که روش تنظیم جدول تناوبی مندلیف سازماندهی نشده و خودسرانه نیست، بلکه بازتاب واقعیتهای عینی است. به طوری که یک شیمیدان میتواند با پیدا کردن جای یک عنصر در جدول و بدون حتی در اختیار داشتن نمونهای از آن عنصر، خواص و اطلاعات مختلف آن را دریابد و بغهمد که آن عنصر فلز، گاز نجیب یا فلز قلیایی است. همچنین میتواند اطلاعات نحوه واکنش آن عنصر با عناصر دیگر را از روی جدول حدس بزند. همین روش تنظیم مندلیف بود که دانشمندان بعد از خود را به خواص عناصری تا آن زمان کشف نشده بودند، آگاه کرد، چرا که جاهای خالی در جدول مندلیف وجود داشت که بعد از وی پر شد. شاهکارهای مندلیف در ساخت شهرک عناصر به شرح زیر میباشد.
روابط همسایگی
دانشمندان پیش از مندلیف در طبقهبندی عناصر هر یک را جداگانه و بدون وابستگی به سایر عناصر در نظر میگرفتند. اما مندلیف خاصیتی را کشف کرد که روابط بین عنصرها را به درستی نشان میداد و ان را پایه تنظیم عناصر قرار داد.
وسواس وی
او برخی از عناصر را دوباره بررسی کرد تا هر نوع ایرادی را که به نادرست بودن جرم اتمی از بین ببرد. در برخی موارد به حکم ضرورت اصل تشابه خواص در گروهها را بر قاعده افزایش جرم اتمی مقدم شمرد.
واحدهای خالی
در برخی موارد در جدول جای خالی منظور کرد. یعنی هر جا که بر حسب افزایش جرم اتمی عناصر باید در زیر عنصر دیگری جای میگرفت که در خواص به آن شباهتی نداشت آن مکان را خالی میگذاشت و آن عنصر را در جایی که تشابه خواص رعایت میشد جای داد. این خود به پیشبینی تعدادی ا زعنصرهای ناشناخته منتهی شد.
استقبال از ساکنان بعدی
مندلیف با توجه به موقعیت عنصرهای کشف نشده و با بهرهگیری از طبقهبندی «دوبرایز» توانست خواص آنها را پیشبینی کند. برای نمونه مندلیف در جدولی که در سال ۱۸۶۹ تنظیم کرده بود، مس و نقره و طلا را مانند فلزی قلیایی در ستون نخست جا داده بود اما کمی بعد عناصر این ستون را به دو گروه اصلی و فرعی تقسیم کرد. سپس دورههای نخست و دوم و سوم هر یک شامل یک سطر و هر یک از دورههای چهارم به بعد شامل دو سطر شده و به ترتیب از دورههای چهارم به بعد دو خانه اول و شش خانه آخر از سطر دوم مربوط به عناصر اصلی آن دوره و هشت خانه باقیمانده سطر اول و دو خانه اول سطر دوم مربوط به عناصر فرعی بود.
ساخت واحد مسکونی
مندلیف با توجه به این که عناصرآهن، کبالت، نیکل، روتینیم، رودیم، پالادیم، اسمیم، ایریدیم و پلاتین خواص نسبتا با یکدیگر دارند این عناصر را در سه ردیف سه تایی و در ستون جداگانهای جای داد و به جدول پیشین خود گروه هشتم را هم افزود.
در آن زمان گازهای نجیب شناخته نشده بود از این رو در متن جدول اصلی مندلیف جایی برای این عناصر پیشبینی نشد. پس از ان رامسی و رایله در سال ۱۸۹۴ گاز آرگون را کشف کردند و تا سا ل ۱۹۰۸ گازهای نجیب دیگر کشف شد و ظرفیت شیمیایی آنها هم در نظر گرفته شد و به «گازهای بیاثر» شهرت یافتند.
جدول مندلیف در تنظیم و پایدار کردن جرم اتمی بسیاری از موارد مندلیف نادرست بودن جرم اتمی برخی از عناصر را ثابت و برخی دیگر را درست کرد. جدول تناوبی نه تنها به کشف عنصرهای ناشناخته کمک کرد بلکه در گسترش و کامل کردن نظریه اتمی نقش بزرگی بر عهده داشت و سبب آسان شدن بررسی عناصر و ترکیبهای آنها شد.
نارساییها
جدول تناوبی با نارساییهایی همراه بود که عبارتند از:
- جای هیدروژن در جدول بطور دقیق مشخص نبود. گاهی آن را بالای گروه فلزهای قلیایی و گاهی بالای گروههای گروه هالوژنها جا میداد.
- در نیکل و کبالت که جرم اتمی نزدیک به هم دارند، خواص شیمیایی متفاوت است و با پایه قانون تناوبی ناسازگاری دارد.
- کبالت را پیش از نیکل و همچنین تلور را پیش از ید جای داد که با ترتیب صعودی جرم اتمی همخوانی نداشت. با پیشرفت پژوهشها و با کشف پرتو ایکس و بررسی دقیق طیف عنصرها، عدد اتمی کشف و آشکار شد و عناصر بر حسب افزایش عدد اتمی مرتب و نارساییهای جزیی موجود در جدول مندلیف از بین رفت. زیرا تغییرات خواص عناصر نسبت به عدد اتمی از نظم بیشتری برخوردار است تا جرم اتمی آنها.
- سال پس از نشر جدول مندلیف، «لوکا بابودران» با روش طیفنگاری اکاآلومینیوم را کشف کرد و گالیم نامید. ۴ سال بعد «نیلسون» اکابور را کشف کرد و اسکاندیم نامید. هفت سال بعد «ونیکلر» هم اکاسیلسیم را از راه تجربه طیفی کشف کرد و آن را ژرمانیم نامید.
تغییرات خواص عناصر در دورهها و گروههای جدول
- تغییرات شعاع اتمی: در هر گروه با افزایش عدد اتمی شعاع اتمی افزایش مییابد ودر هر دوره با افزایش عدد اتمی شعاع اتمی به تدریج کوچکتر میگردد.
- تغییرات شعاع یونی: شعاع یون کاتیون هر فلز از شعاع اتمی آن کوچکتر و شعاع هر نافلز از شعاع اتمی آن بزرگتر است. به طور کلی تغییرهای شعاع یونی همان روند تغییرات شعاع اتمی است.
- تغییرات انرژی یونش: در هر دوره با افزایش عدد اتمی انرژی یونش افزایش مییابد و در هر گروه با افزایش لایههای الکترونی انرژی یونش کاهش مییابد.
- تغییرات الکترونخواهی : در هر دوره با افزایش عدد اتمی انرژی الکترونخواهی افزایش مییابد و در هر گروه با افزایش عدد اتمی اصولا انرژی الکترونخواهی از بالا به پایین کم میشود.
- تغییرات الکترونگاتیوی: در هر دوره به علت افزایش نسبتا زیاد شعاع اتمی الکترونگاتیوی عناصر کم میشود و در هر دوره به علت کاهش شعاع اتمی الکترونگاتیوی عناصر افزایش مییابد.
- تغییرتعداد الکترونهای لایه ظرفیت و عدد اکسایش: در هر دوره از عنصری به عنصر دیگر، یک واحد به تعداد الکترونهای ظرفیت افزوده میشود و تعداد این الکترونها و عدد اکسایش در عنصرهای هر گروه با هم برابرند.
- تغییرات پتانسیل الکترودی: در ازای هر دوره با افزایش عدد اتمی توانایی کاهندگی عنصرها کاهش مییابد و توانایی اکسیدکنندگی آنها افزایش مییابد. از این رو فلزهایی که در سمت چپ دورهها جای دارند، خاصیت کاهندگی و نافلزهایی که در سمت راست دورهها جای دارند، توانایی اکسیدکنندگی دارند. در مورد عناصر یک گروه توانایی اکسیدکنندگی با افزایش عدد اتمی و پتانسیل کاهش مییابد.
- تغییرات توانایی بازی هیدروکسید: توانایی بازی هیدروکسید عناصر در گروهها از بالا به پایین افزایش مییابد اما در دوره از سمت چپ به راست رو به کاهش است.
- تغییرات دما و ذوب یا جوش: در هر دوره دمای ذوب و جوش تا اندازهای به طور تناوبی تغییر میکند ولی این روند منظم نیست و در مورد عناصرگروهها نیز روند واحدی وجود ندارد.
چگونگی کار مندلیف
در سال 1869 که دیمتری مندلیف روی طبقهبندی بهتر عنصرها تحقیق میکرد فقط ۶۳ عنصر شناخته شده بود او ۶۳ کارت تهیه کرد و روی هر کارت علاوه بر نام عنصر برخی خواص شناخته شده آن عنصر را نوشت. مثل دمای ذوب و جوش و جرم اتمی و... بعد این کارتها را به ترتیب افزایش ویژگیهای مختلف کنار هم قرار میداد؛ مثلا یکبار به ترتیب افزایش دمای ذوب و بار دیگر به تریب افزایش ویژگی دیگر.
وقتی مندلیف عنصرها را به ترتیب افزایش جرم اتمی کنار هم به صورت یک ردیف ۶۳تایی چید به نکته جالبی برخورد کرد. او دید که ویژگیهای نوشته شده روی کارتها ۸ تا ۸ تا تکرار میشود یعنی ویژگیهای روی کارت اول مشابه کارت نهم و هفدهم و... و کارت دوم مشابه کارت دهم و هجدهم و... است. کار جالبی که مندلیف انجام داد این بود که ضمن رعایت افزایش تدریجی جرم اتمی عنصرها کارتهایی که ویژگیهای مشابه داشتند، زیر هم در یک ستون قرار داد تا چیزی شبیه یک جدول درست شود به نحوی که عنصرها به ترتیب افزایش جرم اتمی کنار هم قرار گرفتهاند و عنصرهای یک ستون نیز خواص مشابهی دارند. این اساس کار مندلیف برای تنظیم جدول تناوبی بود.
در جدول تناوبی مندلیف فقط ۶۳ عنصر قرار داشت بنابراین بدیهی است که انتظار داشته باشیم برخی از جاهای جدول او نسبت به جدول امروزی خالی باشد در واقع مندلیف برای نظم دادن به جدول خود مجبور بود برخی از خانههای جدول را خالی نگه دارد تا عنصرهای مشایه زیر هم قرار گیرند. او تصور میکرد این جاهای خالی مربوط به عنصرهایی است که هنوز کشف نشدهاند و حتی توانست برای آنها برخی خواصشان را پیشبینی کند. چون باید خواصی بینابین عنصر بالاتر و پایینتر از خود در یک ستون داشته باشد. او همچنین از روی این جدول توانست وجود بعضی از عناصر را که تا آنروز کشف نشده بود حدس بزند و همین امر و پیشبینیهای او که درست از آب در میآمد سبب شهرت زیاد او نسبت به سایر دانشمندان همدورهاش گردید.
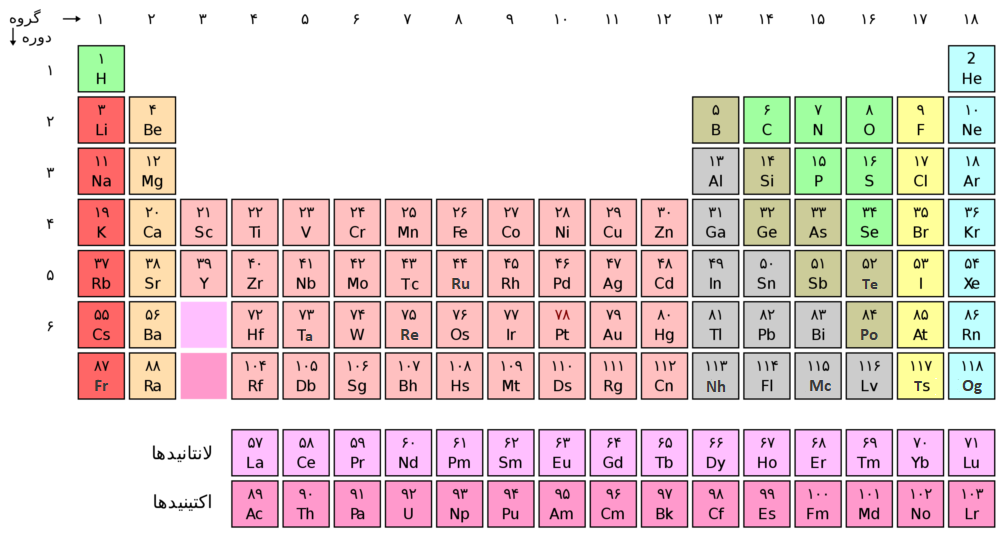
جدول امروزی
در جدول تناوبی که امروزه ما میبینیم ساختار کلی همان است که در جدول مندلیف وجود داشت اما عناصر بجای جرم اتمی بر اساس عدد اتمی در جدول قرار میگیرند. البته با این تصحیح جای عنصرها عوض نمیشود.
ردیفهای افقی جدول را دوره، و ردیفهای عمودی آن را گروه مینامند و عناصر براساس اربیتالی از آنها که آخرین الکترون اتم در آن جا گرفته است به چهار بلوک s,p,d و f طبقهبندی می شوند. عناصر دو بلوک s و p عناصر اصلی، عناصر بلوک d عناصر واسطه و عناصر بلوک f لانتانیدها و اکتینیدها میباشند. شمارهگذاری گروهها از یک تا 18 و شمارهگذاری تناوبها از یک تا 7 میباشد.
چگونه از جدول تناوبی استفاده نمائیم؟
یک جدول تناوبی میتواند شامل اطلاعات متفاوت و متنوعی باشد که بسته به نوع کاربردی که از آن متصور است طراحی میشود، در یک جدول معمولی میتوان علامت اختصاری عناصر، عدد اتمی و جرم اتمی آنها را یافت. همچنین از روی گروهی که آن عنصر به آن وابسته است خصوصیات شیمیایی آنرا حدس زد.
مثلا در گروه 1 که فلزات قلیایی جای دارند عناصر وابسته به آن فلزاتی هستند به شدت واکنشپذیر، که در طبیعت بطور خالص یافت نمیشوند و برای تهیه آنها معمولا از روشهای مشکل الکترولیز استفاده میشود که در این روشها ممکن است از نمک هالوژن مذاب آنها استفاده کنند. این فلزات با آب به شدت واکنشپذیرند و تعدادی از آنها در واکنش با آب تولید مقادیر زیادی حرارت و گاز هیدروژن میکنند که گاز تولید شده در اثر حرارت آتش میگیرد و واکنش با شعله همراه خواهد بود.
همانطور که میبینید یک گروهبندی ساده خواص بسیار زیادی از مواد را در اختیار ما قرار میدهد.
در بعضی جدولهای تناوبی نام انگلیسی عنصر مورد نظر و (یا) آرایش الکترونی عنصر آن نیز نمایش داده شده است. بعضی از آنها شامل نیمهعمر عناصر رادیواکتیو هستند، بعضی ممکن است شکل بلوری نقطه ذوب و جوش و خواص دیگر فیزیکی عنصر را به همراه داشته باشند.
جدول تناوبی تا کجا ادامه خواهد داشت؟
آخرین بار ۴ عنصر جدید به جدول تناوبی مندلیف اضافه شد و ردیف هفتم این جدول را به پایان رساند. حال حدس و گمانهایی دربارهی کشف و ساخت دیگر عنصرها وجود دارد. عنصرهایی که به علت بالاتر رفتن عدد اتمی، خواص احتمالی آنها با دیگر عنصرهای کشف شده بسیار متفاوت خواهد بود.
از دههی ۱۹۳۰ بود که فیزیکدانها موفق شدند دهها عنصر جدید شیمیایی را شناسایی کنند. اما سوال اینجا است که آیا این کشفیات قرار است تا همیشه ادامه پیدا کنند؟
در ۳۰ دسامبر ۲۰۱۵ دقیقا ۴ عنصر جدید به طور رسمی وارد دنیای شیمی شد. اتحادیهی بینالمللی شیمی محض و کاربردی (آیوپاک) ساخت ۴ عنصر جدیدی را که در محیط آزمایشگاهی تولید شده بودند را تایید کرد.
بعضی از گزارشها حاکی از آن است که این عنصرها روند تناوبی جدول تناوبی را تکمیل کرده و به پایان میرساند. هر چند که این ادعا اشتباه است. چرا که پس از اتمام آخرین دسته از عنصرها باز هم میتوانید با اطمینان خاطر منتظر ساخت عنصرهای بیشتری باشید. با این حال روند کشف این عنصرها سختتر بوده و مستلزم زمان بیشتری است.
این عنصرهای جدید ساخته شده ردیف هفتم جدول تناوبی را تکمیل کردهاند. چنانچه عنصرهایی با اعداد اتمی ۱۱۹ یا ۱۲۰ ساخته شوند، ردیف بعدی در جدول، شکل خواهد گرفت.
هیچ کس نمیداند که عنصرهای جدید تا کجا این جدول را ادامه خواهند داد. بعضی گمانهزنیها محدودیتی برای این گستردگی قائل نمیشوند. برخی دیگر هم این نکته را مد نظر قرار میدهند که عنصرها حجم محدودی از اتمها را میتوانند تحمل کنند و چنانچه عنصری از تعداد اتم بالایی برخوردار شود، ناپایدار شده و در اثر آشفتگی رادیواکتیویته از هم پاشیده خواهد شد.
با این حال واضح است که حتی اگر دست به ساخت عنصرهایی بزنیم که روند سنگینتر شدن را طی میکنند، راهکارهایی برای جلوگیری از فروپاشی آنها هم پیدا خواهیم کرد.
جدول تناوبی دستخوش تغییر میشود؟
جدول تناوبی مندلیف برای بیش از یک قرن، یکی از بخشهای اصلی درس شیمی مدارس بوده، اما اکنون پس از کشفیات جدید دانشمندان در مورد یک عنصر نادر، ممکن است دستخوش تغییر شود.
جدول تناوبی مندلیف برای بیش از یک قرن، یکی از بخشهای اصلی درس شیمی مدارس بوده، اما اکنون پس از کشفیات جدید دانشمندان در مورد یک عنصر نادر، ممکن است دستخوش تغییر شود.سازمان انرژی اتمی ژاپن برای نخستینبار به بررسی عنصر لارنسیم پرداخته که تولید آن بسیار مشکل است و از نیمه عمر 27 ثانیهای برخوردار است.
محققان دریافتند که لارنسیم با سایر عناصر نادر رادیواکتیو در بلوک F متفاوت بوده و تردیدهایی را بوجود آورده که این ماده باید در بدنه اصلی جدول تناوبی قرار بگیرد. آنها برای نخستینبار توانستند میزان انرژی لازم برای جداسازی یک الکترون از اتم عنصر رادیواکتیو لارنسیم را آزمایش کنند.
این فلز نادر در حال حاضر در انتهای جدول تناوبی و در انتهای گروهی از عناصر موسوم به آکتینیدها قرار دارد که در بلوکی مجزا از جدول اصلی است. اما نتایج تحقیقات جدید نشان میدهد که این عنصر احتمالا از ویژگیهای مشابه سدیم و پتاسیم برخوردار است که میتواند باعث بروز بحثهایی در مورد تغییر جایگاه این عنصر به بدنه اصلی جدول تناوبی شود.
در صورت تغییر جایگاه لارنسیم، دانشآموزان احتمالا باید مجددا در کلاسهای شیمی به یادگیری جایگاه عناصر در جدول بپردازند.
لارنسیم که ابتدا در سال 1961 توسط ارنست لارنس، دانشمند هستهای آمریکایی کشف شده بود، تنها چند ثانیه عمر میکند و تولید آن بسیار مشکل است؛ این امر باعث شده بررسی عنصر مذکور که تنها توسط شتابدهندههای ذره قابل تولید است، بسیار مشکل شود. اکنون محققان ژاپنی توانستهاند برای نخستینبار، میزان کافی از این عنصر را برای سنجش یونیزاسیون بالقوه لارنسیم ایجاد کنند.
ساختار کنونی جدول تناوبی در سال 1945 و پس از پیشنهاد آکتینیدها توسط گلن سیبورگ، شیمیدان برنده جایزه نوبل ترسیم شد. اگرچه برخی شیمیدانها بر این باورند که قرار دادن لارنسیم در انتهای بلوک F – آکتینیدها – درست نبوده و باید آن را در بلوک d ستون اصلی جدول قرار دهند.
دکتر ویلیام جنسن، شیمیدان دانشگاه سینسیناتی بر این باور است که قرار دادن لارنسیم و همچنین لوتیتیم در بلوک F اشتباه بوده است. وی در مقالهای که در مجله بنیادهای شیمی منتشر شد، عنوان کرد: اگرچه تصورات غلط زیادی در مورد ذات و عملکرد قانون و جدول تناوبی وجود دارد، اما رایجترین آن در میان شیمیدانان مدرن این است که جدول تناوبی چیزی بجز یک جدول پیکربندی الکترون نیست. اگرچه ارتباط معنیداری بین آرایش الکترونی و دوره تناوب شیمیایی وجود دارد، اما این ارتباط از یک ساختار کامل فاصله دارد.
جنسن افزود: عناصر لوتیتم و لارنسیم باید به جای لانتانیم و آکتینیوم در بلوک d به عنوان مکملهای سنگینتر اسکاندیم و ایتریوم قرار بگیرند، در حالیکه عناصر لانتانیم و آکتینیوم باید به عنوان اولین اعضای بلوک F با پیکربندی نامنظم در نظر گرفته شوند.
لارنسیم ابتدا توسط ارنست لاورنس با بمباران اتم کالیفرنیم توسط اتمهای بارون به منظور ایجاد یک عنصر فوق سنگین جدید تولید شد، اما دانشمندان تنها توانستهاند مقادیر بسیار کمی از ماده را با نیمه عمر 27 ثانیه تولید کنند. تحقیق جدید از همین رویکرد برای ایجاد لارنسیم استفاده کردند، اما آن را در گاز یدید هلیوم و کادمیوم گیر انداختند. این عنصر از میان یک سطح داغ شده تانتالوم عبور کرد تا به لارنسیم اجازه تولید انرژی کافی برای یونیزه کردن الکترون خارجیاش بدهد.
دانشمندان دریافتند که این میزان مطابق با یک پیشبینی اخیر 4.69 الکترونولت است که کمترین پتانسیل یونازیسیون در میان همه عناصر بلوک F محسوب میشود. اگرچه سازمان انرژی اتمی ژاپن در بیانیهای اعلام کرد، به نظر نمیرسد که این دستاورد تاثیری بر ساختار جدول تناوبی داشته باشد.
در این بیانیه آمده است: از زمان معرفی مفهوم آکتینیدها در چشمگیرترین نسخه مدرن از جدول تناوبی عناصر توسط گلن سیبورگ در دهه 1940، عنصر لارنسیم با عدد اتمی 103 نقشی اساسی به عنوان عنصر آخر گروه آکتینیدها ایفا کرده است. ما نشان دادیم که حذف بیرونیترین الکترون نیازمند کمترین انرژی در لارنسیم نسبت به سایر آکتینیدها است. این امر، موقعیت لارنسیم را به عنوان آخرین عنصر آکتینید معتبر ساخته و ساختار جدول تناوبی را تائید میکند.
اما دانشمندان دیگر مانند دکتر اریک سری از دانشگاه کالیفرنیا در لسآنجلس بر این باورند که نتایج جدید، از تغییر جایگاه لارنسیم به بخش اصلی جدول تناوبی حمایت میکند.
گردآورنده: دنیاها، دانشنامۀ فارسی | www.donyaha.ir
![]()




