در جدول دورهای (تناوبی) امروزی، عنصرها براساس افزایش عدد اتمی سازماندهی شدهاند، بهطوری که جدول دورهای عنصرها از عنصر هیدروژن با عدد اتمی یک (Z=1) آغاز و به عنصر شمارۀ 118ختم میشود. این جدول، 7دوره و 18گروه دارد. هر ردیف افقی جدول، که نشان دهندۀ چیدمان عنصرها برحسب افزایش عدد اتمی است، دوره نام دارد؛ در حالی كه هر ستون، شامل عنصرها با خواص شیمیایی مشابه است و گروه نامیده میشود.
بدیهی است خواص شیمیایی عنصرهایی که در یک دوره از جدول جای دارند، متفاوت است. با پیمایش هر دوره از چپ به راست، خواص عنصرها بهطور مشابه تکرار میشود؛ از این رو چنین جدولی را جدول دورهای (تناوبی) عنصرها نامیدهاند.
خواص فیزیكی و شیمیایی عنصرها بهصورت دورهای تكرار میشود كه به قانون دورهای عنصرها معروف است.
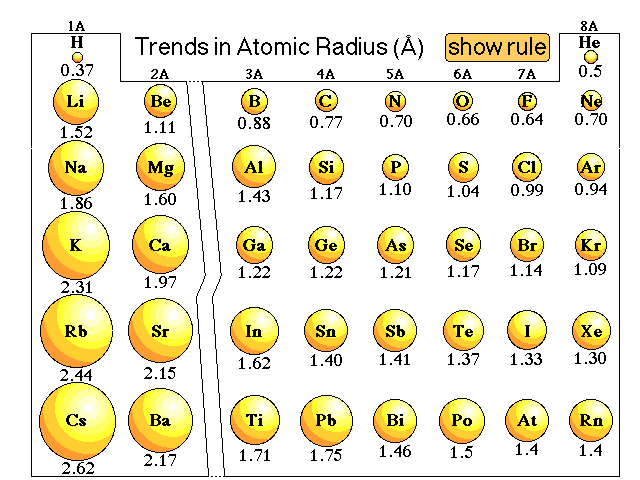
شعاع کووالانسی
نصف فاصله هستهها در یک مولکول دو اتمی جور هسته را «شعاع کووالانسی» میگویند.
بطور کلی شعاع کووالانسی در جدول تنابی از چپ به راست کاهش و از بالا یه پایین افزایش مییابد. علت این است که در یک دوره (تناوب) از چپ به راست که میرویم تعداد لایههای الکترونی ثابت است ولی بار مثبت هسته افزایش مییابد در نتیجه الکترونهای بیرونی را بیشتر به سوی خود کشیده و اتم کوچکتر میشود.
در یک گروه از بالا به پایین، از یک طرف، تعداد لایههای الکترونی افزایش یافته پس باید اتم بزرگتر شود و از طرف دیگر، بار مثبت هسته افزایش مییابد پس باید اتم کوچکتر شود. به نظر میرسد این دو عامل باید اثر یکدیگر را خنثی کنند ولی تاثیر زیاد شدن تعداد لایههای الکترونی خیلی بیشتر است.
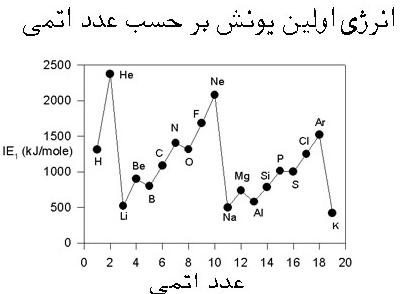
انرژی نخستین یونش
مقدار انرژی لازم برای جدا کردن سستترین الکترون از اتم در حالت گازی شکل و تبدیل آن به یون یک بار مثبت گازی شکل را به ازای یک مول، «انرژی نخستین یونش» میگویند.
انرژی نحستین یونش در هر تناوب از چپ به راست با افزایش عدد اتمی افزایش مییابد ولی عناصر گروههای دوم و پانزدهم در این مورد رفتاری غیرعادی دارند. یعنی انرژی نخستین یونش آنها از عنصر قبل و بعد از خودشان بیشتر است علت این امر به پایداری آرایش الکترونی لایه ظرفیت این عنصرها ربط پیدا میکند که به ترتیب آرایش پر و آرایش نیمه پر دارند.
در یک گروه از بالا یه پایین انرژی نخستین یونش به طور منظم کاهش پیدا میکند.
الکترونگاتیوی
تمایل اتمها برای جذب جفت الکترون پیوندی به سوی خود را «الکترونگاتیوی» میگویند.
در جدول تناوبی از چپ به راست الکترونگانیوی افزایش و از بالا به پایین الکترونگاتیوی کاهش پیدا میکند؛ چون بین الکترونگاتیوی و شعاع کووالانسی رابطه عکس وجود دارد.
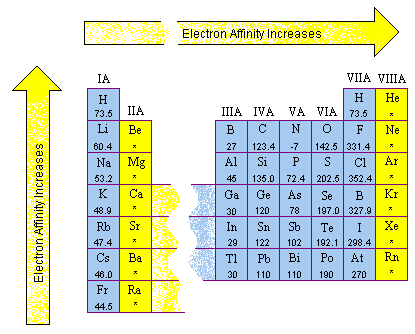
برای مقایسه الکترونگاتیوی دو عنصر کافیست فاصله تقریبی آنها را تا الکترونگاتیوترین عنصر یعنی «فلوئور» بررسی کنیم هرچه عنصرها به فلوئور نزدیکتر باشند الکترونگاتیوی بیشتری دارند.
گردآورنده: دنیاها، دانشنامۀ فارسی | www.donyaha.ir
![]()